Tecniche di monitoraggio batterico [Scarica questo white paper come file PDF]
In tutte le applicazioni industriali e civili dove vengono utilizzati acqua od altri liquidi vengono comunemente applicate pratiche volte a prevenire la proliferazione di batteri ed altri microbi. Nonostante questo aspetto sia d'importanza critica, l'approccio adottato risulta spesso incompleto se non, addirittura, totalmente errato. Comunemente, vengono effettuati notevoli sforzi per il monitoraggio dei batteri liberi nel liquido. Nonostante ciò rappresenti uno standard ampiamente applicato, questo approccio non tiene in considerazione lo strato batterico adeso alle superfici in contatto con il liquido, al quale si fa in genere riferimento con il termine "biofilm". Fino al 90% dei batteri totali presenti all'interno di una tubazione vivono nel biofilm, e le analisi di campioni di acqua o, più in generale, di liquido, non permettono di rilevare la loro presenza. Perciò, questo metodo standard fornisce solo una visione parziale riguardo la reale contaminazione batterica del sistema (v. figura sottostante).
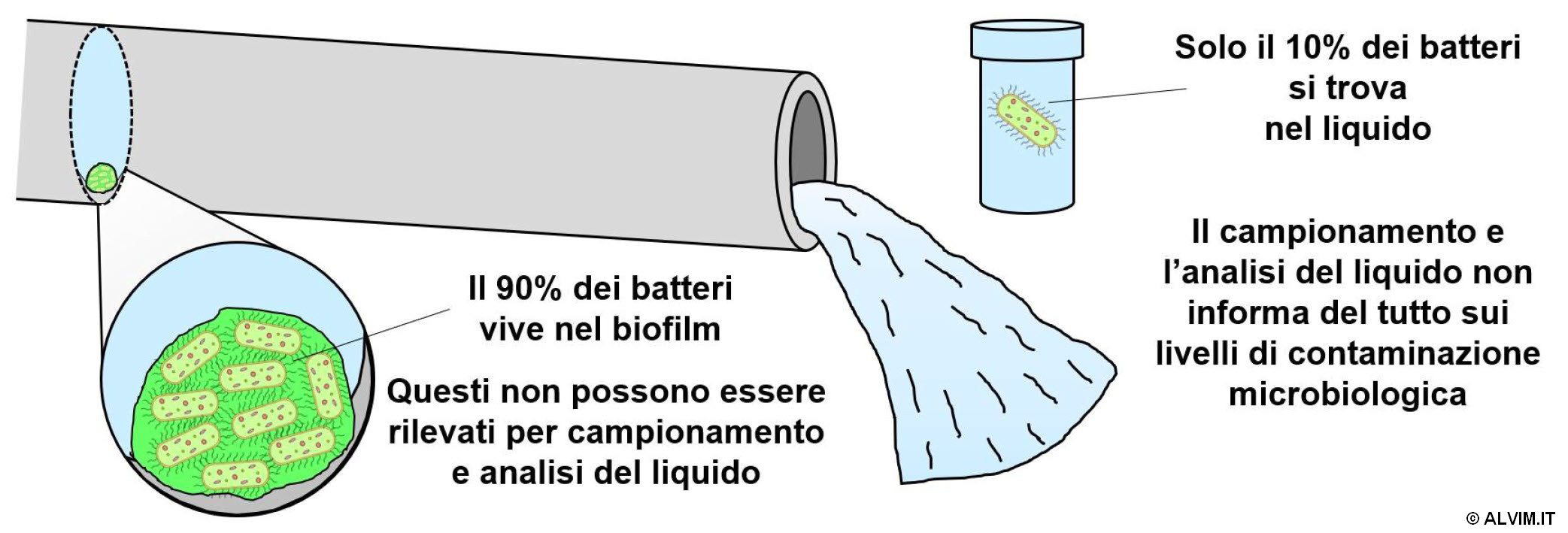
Inoltre, il biofilm costituisce la maggiore sorgente di contaminazione microbiologica, con i problemi che ne derivano. Di conseguenza, risulta estremamente importante monitorare la crescita di biofilm, per poter ottimizzare il trattamento di sanificazione ed ottenere una rimozione completa ed efficiente di questi microorganismi. Una crescita incontrollata di questo strato batterico porta all'insorgere di serie problematiche, tra le quali guasti ai macchinari, efficienza di filtrazione ridotta, maggior consumo di energia, corrosione indotta da microbi e resistenza ai trattamenti di sanificazione. Infatti, il biofilm produce sostanze polimeriche extracellulari (EPS) che avvolgono i batteri e li proteggono dall'azione di biocidi ed altri agenti sanificanti. Per questa ragione, il biofilm è molto più difficile da rimuovere, rispetto ai batteri liberi nel liquido. Proprio per questo motivo tutti i protocolli di sanificazione dovrebbero essere mirati espressamente alla rimozione del biofilm, allo scopo di mantenere la proliferazione batterica sotto controllo. I diversi protocolli biocida disponibili ed il loro impatto sul biofilm sono discussi in un altro white paper ALVIM.
Per stabilire un efficace trattamento di sanificazione e rimuovere il biofilm, è importante conoscere il livello di contaminazione del sistema. Per raggiungere tale scopo, sono disponibili diversi metodi di monitoraggio batterico, i quali possono essere classificati in secondo lo schema seguente (v. figura sottostante).
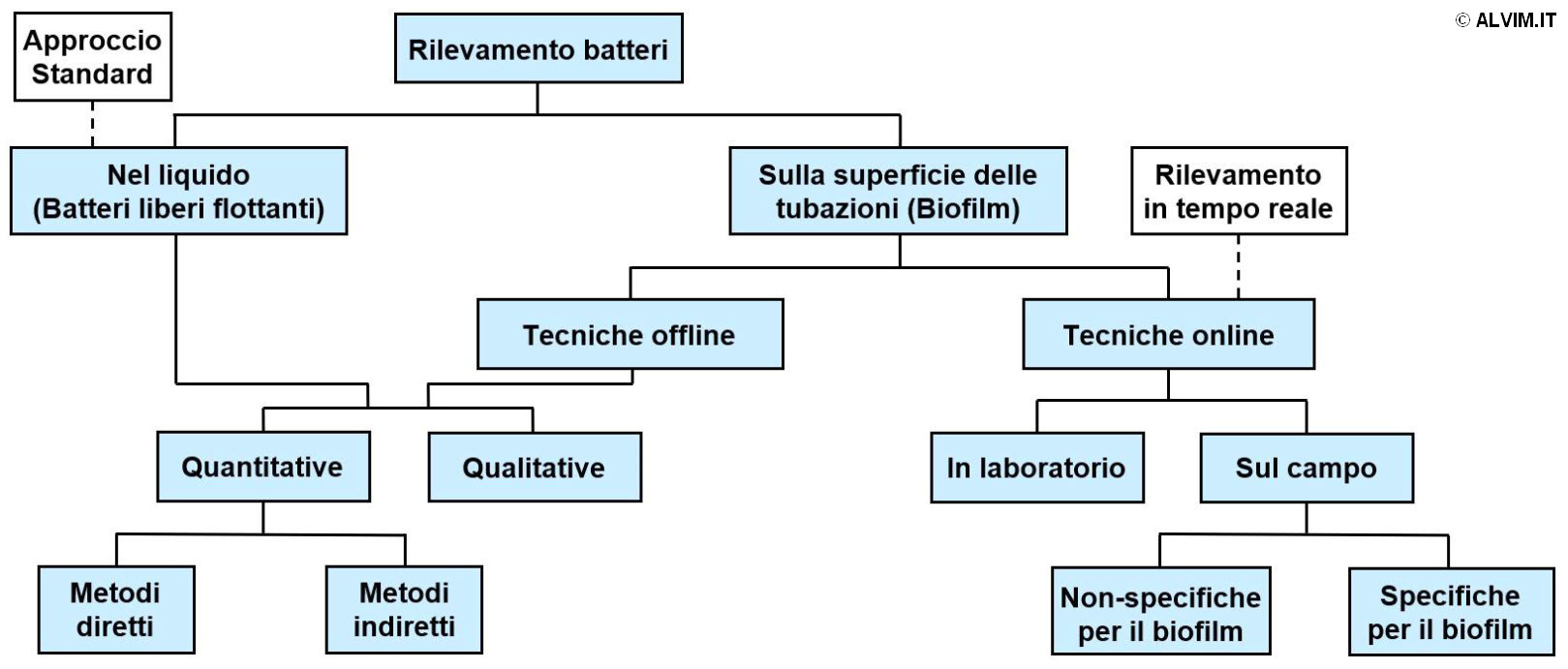
Le tecniche di rilevamento di batteri sulla superficie delle tubazioni si differenziano da quelle standard, le quali consentono di analizzare solamente i microorganismi presenti nel liquido, come discusso precedentemente. I metodi che consentono di monitorare il biofilm offline possono comprendere tecniche di analisi quantitativa o qualitativa; lo stesso vale per il monitoraggio nel liquido. Tutti questi metodi richiedono il campionamento del biofilm, il quale comporta, allo stesso tempo, maggior impegno e tempistiche più dilatate per svolgere le analisi. Diversamente, le tecniche online offrono un notevole beneficio, permettondo di rilevare la crescita di biofilm più velocemente. Tra queste, vi sono numerosi applicazioni di laboratorio, che non risultano ancora pronte per l'impiego nel settore industriale. Numerose applicazioni di campo sono invece disponibili sul mercato, nonostante la maggior parte di esse non consenta di rilevare specificamente il biofilm, ma il deposito generico (il quale include il biofilm, ma anche incrostazioni minerali, ecc.). Ciò comporta una forte limitazione, in quanto l'informazione relativa al deposito generico non consente di ottimizzare i trattamenti di sanificazione. Attualmente, le sole tecniche riconosciute per essere in grado di rilevare il biofilm in maniera specifica ed affidabile sono rappresentate dai sensori elettrochimici. Tra queste, la Tecnologia ALVIM per il Monitoraggio del Biofilm è ampiamente riconosciuta come la miglior soluzione disponibile, e come punto di riferimento internazionale, per il rilevamento del biofilm.
Nei seguenti pragrafi, le diverse categorie sopra menzionate verranno introdotte, ed i metodi più comunemente impiegati verranno discussi nel dettaglio.
Rilevamento dei batteri nel liquido
Esiste un'ampia varietà di tecniche volte a rilevare i batteri liberi nel liquido. Nella maggior parte dei casi, la determinazione analitica segue uno step preliminare mirato alla preparazione del campione ed alla concentrazione dei batteri in esso presenti. Questa pratica può prevedere, ad esempio, metodi di sedimentazione, ultracentrifugazione o filtrazione, seguita da risospensione. Tutte queste operazioni, che devono essere condotte all'interno di un laboratorio dedicato, aumentano considerevolmente il tempo richiesto per l'analisi. Per quanto concerne l'enumerazione dei batteri, si ricorre in genere a tecniche colturali, che prevedono il conteggio delle unità formanti colonia (CFU) in campioni di liquido. Tra queste, il conteggio dei batteri eterotrofi su piastra (HPC, precedentemente noto come conteggio standard su piastra, SPC, o conteggio totale su piastra, TPC), che quantifica i batteri eterotrofi vitali e coltivabili, costituisce il metodo di analisi più comune. È molto importante sottolineare che questi metodi sono spesso scarsamente rappresentativi della situazione reale, poiché meno dell'1% del numero totale di batteri può essere coltivato con successo in condizioni di laboratorio. Infatti, la maggior parte dei batteri non è in grado di crescere su terreni di laboratorio, rientrando nella categoria dei batteri vitali ma non coltivabili (VBNC).
Lo stesso vale anche per i kit di monitoraggio batterico, i quali stanno ricevendo un interesse crescente sul campo, poiché il loro utilizzo è generalmente più semplice, e consentono un rilevamento più rapido - anche se, in certi casi, la loro accuratezza è limitata.
Metodi Quantitativi
Le tecniche che consentono di quantificare i batteri presenti nel sistema permettono di stabilire una soglia al di sopra della quale dovrebbe essere applicato un trattamento di sanificazione. Essi non forniscono informazioni relative al tipo di batteri rilevati, e quindi circa l'eventuale presenza di patogeni (come ad esempio Legionella o Listeria).
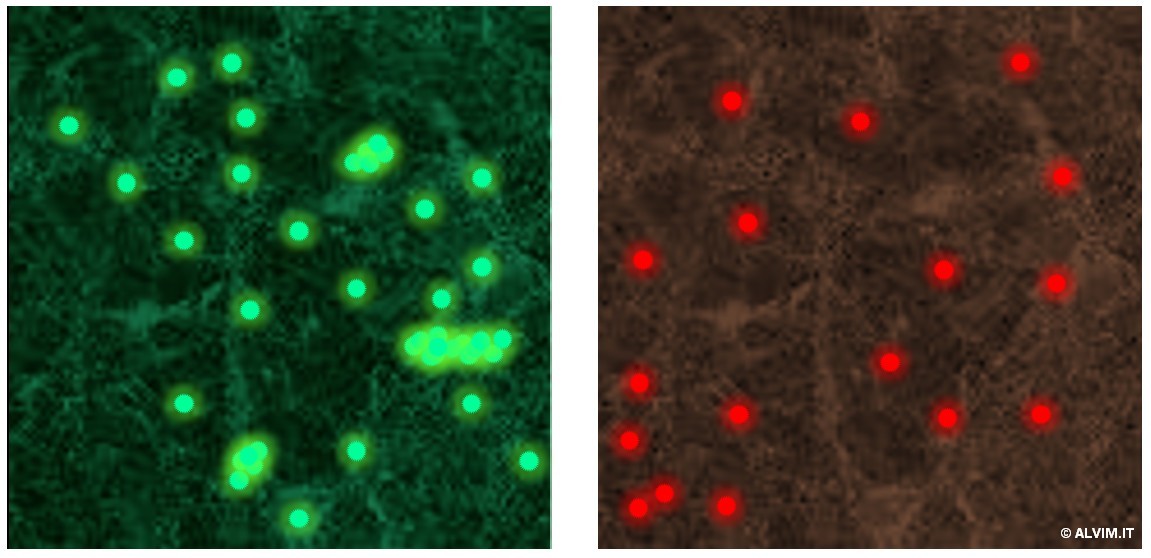
I metodi quantitativi possono essere inoltre distinti in due sottocategorie, diretti e indiretti, in riferimento alla tecnica applicata. I metodi diretti si basano sul conteggio e la visualizzazione dei batteri; a questo proposito, la microscopia rappresenta probabilmente il metodo maggiormente impiegato. Se da una parte i batteri possono essere visualizzati e conteggiati per mezzo di un semplice microscopio a luce composta, dall'altra la microscopia a fluorescenza offre grandi benefici. Questa tecnica consente una risoluzione maggiore ed una sensibilità superiore. In aggiunta, il trattamento del campione con coloranti o fluorofori, come l'arancio di acridina od il 4',6-diamidino-2-fenilindolo (DAPI), i quali si possono intercalare il DNA delle cellule batteriche, consentono di discernere i batteri da altre sostanze, portando ad una maggiore sensibilità. A questo proposito, le tecniche di colorazione permettono inoltre di distinguere le cellule vive da quelle morte (ad esempio verdi-vive e rosse-morte, v. figura a destra). Per lo stesso principio, altri saggi, come quello del cristalvioletto, permettono di distinguere batteri gram-negativi dai gram-positivi, consentendo una generica analisi qualitativa. Per quanto riguarda l'uso di strumenti più avanzati (ed anche più costosi), la Microscopia a Scansione Laser Confocale (CLSM) offre caratteristiche aggiuntive. Queste includono la visione tridimensionale e la possibilità di visualizzare simultaneamente diversi marker fluorescenti, con le relative proprietà da essi evidenziate. Inoltre, programmi di imaging avanzati sono spesso utilizzati in combinazione con la microscopia, per aumentare l'accuratezza dell'analisi, e ridurre quindi gli sforzi operativi.
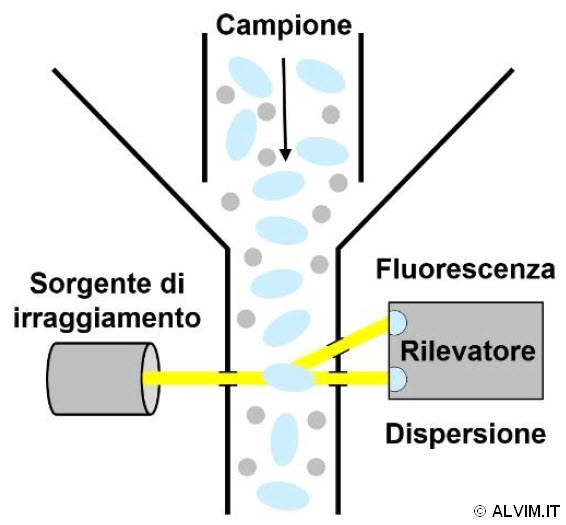
Un altro metodo diretto è rappresentato dalla Citometria in flusso, che consente di conteggiare le singole cellule (o particelle) mentre attraversano una sottile fenditura, sottoposte ad una radiazione singola o multipla. Questa tecnica può impiegare sia la dispersione della luce visibile che l'emissione di fluorescenza (v. figura a sinistra). Un risultato simile, anche se per mezzo di un diverso principio, si può ottenere con un altro metodo noto come coulter counter. Esso consente di analizzare il flusso di particelle cariche che attraversano una soluzione di elettrolita, attraverso una fenditura che è parte di un circuito elettrico. Il conseguente cambiamento di potenziale, determinato dal movimento delle particelle, dipende dalla loro dimensione. Tale correlazione consente di distinguere e contare le singole cellule batteriche. Per quanto riguarda invece i metodi indiretti, essi sfruttano la correlazione del fenomeno biologico rappresentato dalla crescita batterica con diversi parametri fisici. Nella maggior parte dei casi, queste misurazioni sono riferite all'attività metabolica delle cellule. Per esempio, i saggi di bioluminescenza dell'ATP (adenosina trifosfato - il nucleoside atto al trasporto di energia in tutti gli organismi viventi) permettono di dedurre informazioni riguardo la vitalità dei batteri. A tal proposito, viene sfruttata una reazione biochimica con l'enzima luciferina per convertire l'energia chimica dell'ATP in emissione di luce visibile, la quale viene rilevata tramite metodi ottici. I metodi di spettroscopia UV-visibile sono comunemente impiegati, e, quando utilizzati assieme a coloranti a base di sali di tetrazolio, essi diventano potenti strumenti che trovano numerose applicazioni in biologia, per il monitoraggio del metabolismo in vitro.
Metodi qualitativi
L'analisi qualitativa dei batteri presenti nel liquido viene condotta in alcuni campi specifici, inclusi ad esempio il settore alimentare, quello petrolifero o, meno frequentemente, i sistemi di raffreddamento degli edifici pubblici e privati. Questa analisi viene eseguita allo scopo di verificare la presenza di microorganismi specifici, i quali possono causare problematiche rilevanti, incluse possibili epidemie correlate alla contaminazione idrica. A tal proposito, viene comunemente investigata l'eventuale presenza di Legionella, Listeria ed altri patogeni. A seconda del livello di accuratezza richiesto per tale analisi, vengono comunemente impiegati due approcci principali. Quando l'obiettivo è verificare la presenza di un dato microorganismo nel campione, vengono utilizzati i test kit. Questi strumenti consentono una rapida identificazione, che spesso può essere condotta direttamente sul campo, indicando un risultato di tipo positivo o negativo - utile, dunque, come indicazione preliminare. In aggiunta, non è necessario alcuno strumento di laboratorio per condurre questi test. Sebbene l'indicazione fornita possa rivelarsi molto utile, essa è tipicamente caratterizzata da una scarsa accuratezza. In caso di risultato positivo, dovrebbero essere sempre condotte ulteriori analisi, più approfondite. Infatti, quando si pone la necessità di una indagine più accurata, vengono frequentemente impiegate le tecniche di laboratorio basate sull'analisi del DNA. A tale proposito, la PCR (Polymerase Chain Reaction, reazione a catena della polimerasi) rappresenta il metodo più frequentemente impiegato. In questo caso, il contenuto genetico del campione viene amplificato, quindi viene analizzato qualitativamente. È importante sottolineare che le tecniche basate sulla PCR possono anche fornire risultati di tipo semi-quantitativo. Inoltre, tecniche di sequenziamento del DNA, utilizzate in combinazione con software dedicati, possono essere eseguite per studi più approfonditi, che ricadono nel campo della metagenomica.
Rilevamento dei batteri sulle superfici
La crescita e lo sviluppo del biofilm sulla superficie delle tubazioni possono essere monitorati sia tramite tecniche online che offline. Come anticipato in precedenza, il rilevamento del biofilm può essere effettuato per mezzo delle stesse tecniche analitiche impiegate per la determinazione dei batteri flottanti liberi nel liquido. Sfortunatamente, la maggior parte di questi metodi comporta due notevoli svantaggi, richiedendo la raccolta di un campione ed un tempo più o meno lungo per la sua analisi. Le tecniche online, al contrario, non presentano questi svantaggi ed offrono, al tempo stesso, ulteriori benefici. Infatti, monitorare il biofilm tramite tecniche online consente un rilevamento veloce o, addirittura, in tempo reale (v. figura sottostante). Di conseguenza, per mezzo delle tecniche online è possibile intervenire con tempismo quando il biofilm è ancora in fase iniziale, ovvero quando può essere rimosso con la massima efficienza.
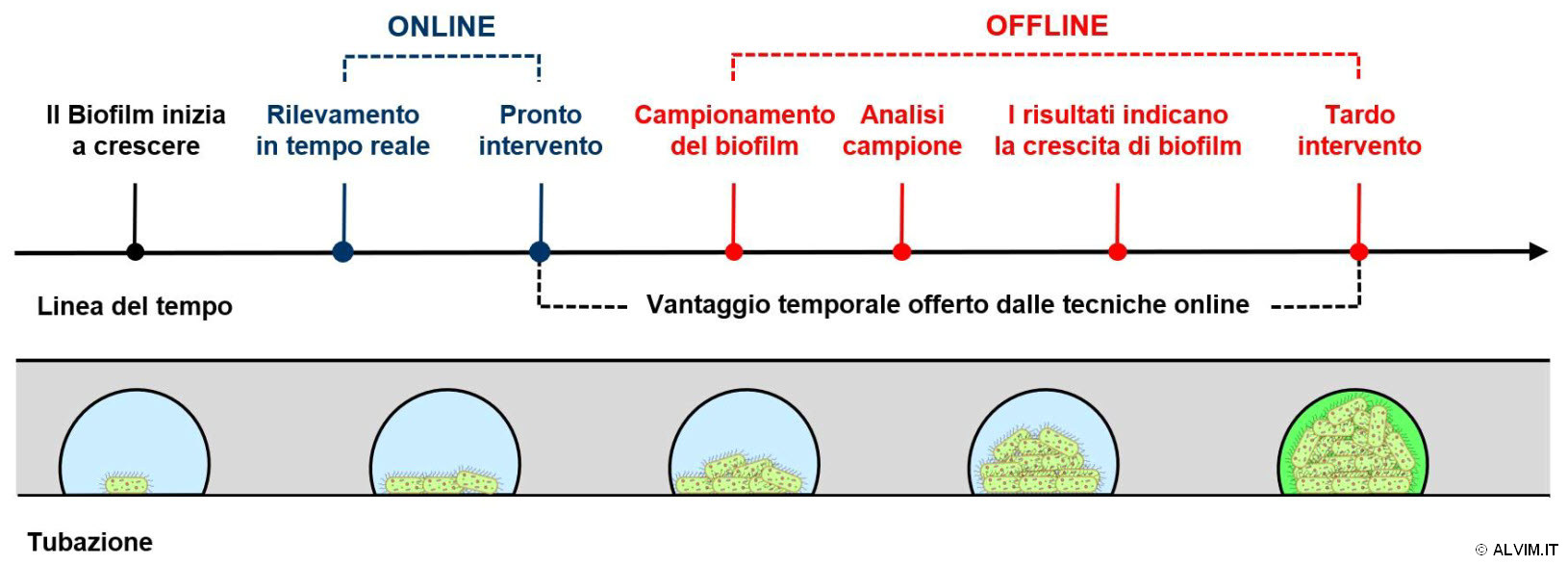
Tecniche offline
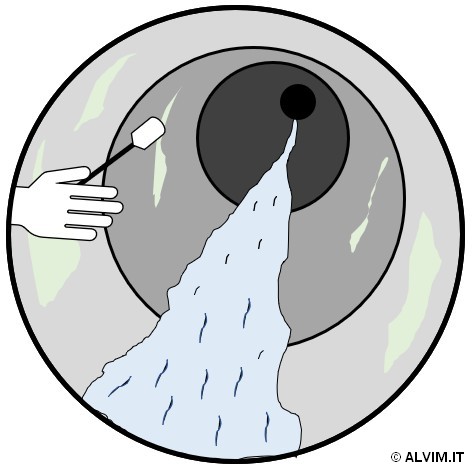
Come menzionato nei paragrafi precedenti, il campionamento del biofilm è richiesto per poter eseguire analisi offline. Per fare ciò, due principali approcci sono possibili. Il primo, metodo più diretto, consiste nel tamponare la superficie interna di tubazioni o altri parti del sistema, allo scopo di raccogliere un campione di biofilm (v. figura a destra). Per poter fare ciò, è spesso necessario interrompere le operazioni, drenare intere parti del sistema ed accedere fisicamente alla superficie interna delle tubazioni. Di conseguenza, tale approccio è spesso di complessa esecuzione, poiché molto intensivo in termini di tempo e denaro investiti. Nonostante gli sforzi richiesti, tale tecnica consente di ottenere campioni altamente rappresentativi. La seconda e più avanzata tecnica di campionamento, sfrutta, invece, piccole placche di diverse dimensioni e materiali, note con il termine di coupon, le quali possono essere inserite e rimosse da supporti dedicati. I coupon vengono inseriti in delle rastrelliere, installate a loro volta in un ramo secondario (bypass) della tubazione, ed il biofilm viene lasciato crescere sulla loro superficie per un dato intervallo di tempo (v. figura sottostante). Successivamente, i coupon vengono prelevati e sostituiti, ed il ricoprimento della loro superficie viene analizzato. È importante sottolineare che, in questo caso, le condizioni di crescita sui coupon cui sono soggetti i microorganismi potrebbero differire, anche notevolmente, da quelle che si verificano sulla superficie della tubazione principale. Ciò può essere dovuto, per esempio, alle diverse condizioni ambientali presenti nel bypass dove sono inseriti i coupon, oppure ai diversi materiali che costituiscono superfici delle tubazioni e placche. Di conseguenza, la rappresentatività di questo tipo di campioni può essere limitata. Una volta ottenuto il campione, esso può essere sottoposto ad analisi quantitative o qualitative (o entrambe).
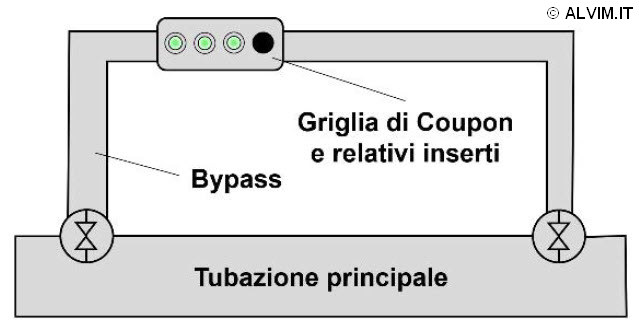
Metodi quantitativi
Tutte le tecniche precedentemente menzionate per il rilevamento dei batteri nel liquido possono essere applicate anche per l'analisi quantitativa, offline, dei batteri presenti sulla superficie interna delle tubazioni. Tuttavia, se nel caso dei liquidi il campionamento è una procedura semplice, lo stesso non vale nel caso del biofilm, per il quale sono richieste operazioni più complesse, come discusso in precedenza. Oltre ai metodi precedentemente descritti per il rilevamento dei batteri nel liquido, sono disponibili anche altre tecniche, che consentono di rilevare la crescita di biofilm in maniera indiretta. È importante notare che l'indicazione fornita da questi metodi dovrebbe sempre essere successivamente validata per mezzo di un saggio diretto. Oltre ai metodi basati su ATP e spettroscopia UV-visibile già descritti, esistono altri comuni metodi indiretti per il rilevamento di batteri su superfici a contatto con il liquido. Questi metodi sfruttano la misura dello sviluppo di biomassa tramite la determinazione di massa secca, carbonio organico totale (TOC) e determinazione delle proteine totali (v. figura sottostante).
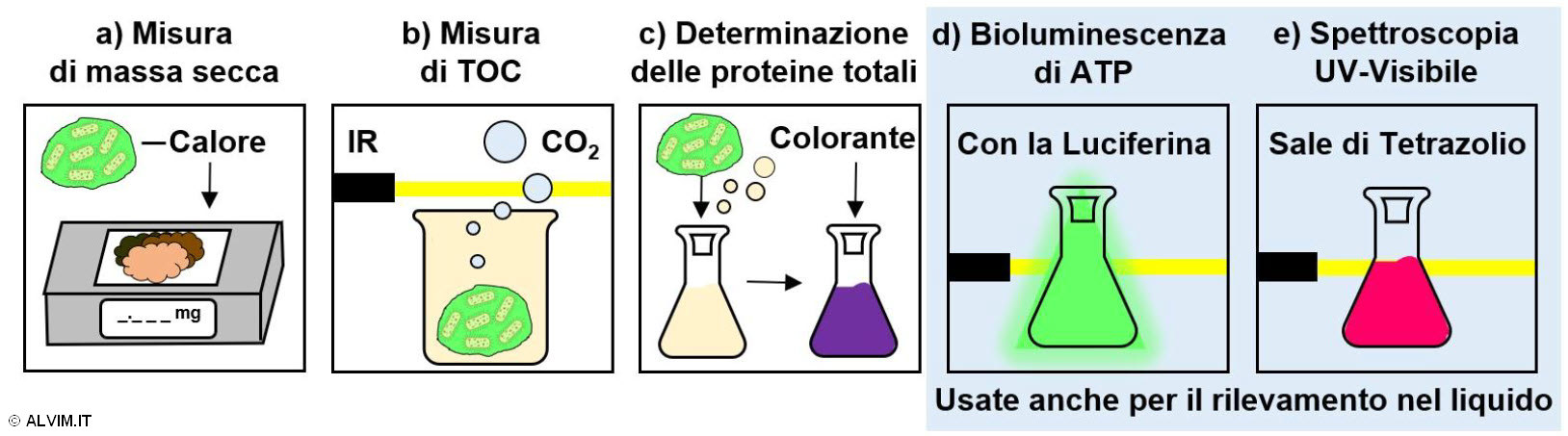
La misura della massa secca (v. figura sopra, punto a) viene eseguita previo riscaldamento del campione di biofilm a temperatura costante, in modo da rimuovere completamente il contenuto d'acqua; dopodiché, il materiale secco rimanente viene quantificato. Poiché, a seconda della situazione, il quantitativo di EPS prodotte dai batteri potrebbe differire in modo considerevole, questo metodo potrebbe portare a correlazioni ingannevoli tra contenuto di massa secca e crescita di biofilm.
La misura del TOC (v. figura sopra, punto b) viene eseguita previa dissoluzione del biofilm in acido, a caldo. Questo processo porta alla formazione di un volume di diossido di carbonio che è proporzionale al contenuto complessivo di batteri ed altro materiale organico originariamente presenti nel campione. La quantificazione del diossido di carbonio così prodotto può essere eseguita, per esempio, tramite spettroscopia infrarossa.
La determinazione delle proteine totali (v. figura sopra, punto c) viene eseguita inducendo la lisi del campione di biofilm in condizioni acide o basiche. In seguito, il lisato cellulare risultante viene trattato con un colorante, come per esempio l'acido bicinconinico, il reattivo di Bradford o quello di Lowry. In seguito, una determinazione spettroscopica fornisce il risultato finale.
È importante sottolineare come queste tecniche, che sono di tipo distruttivo, non consentano la distinzione tra batteri ed altri microorganismi, o tra biofilm ed altre sostanze. Di conseguenza, l'impiego di questi metodi non comporta la scelta più adatta quando si tratta di monitoraggio del biofilm.
Metodi qualitativi
Come nel caso dei metodi quantitativi, anche l'approccio qualitativo può avvalersi dalle stesse tecniche che vengono impiegate per il monitoraggio dei batteri flottanti nel liquido. In questo caso, il campionamento costituisce una fase ancor più delicata, a causa della più elevata richiesta in termini di rappresentatività ed accuratezza.
Tecniche online
Nell'ultimo decennio, l'approccio al controllo microbiologico basato sul monitoraggio del biofilm è cresciuto in termini di popolarità ed importanza nel settore del trattamento acque. Mentre il numero di applicazioni è ancora limitato, ci si aspetta che il suo impiego aumenti notevolmente negli anni a venire, soprattutto considerando gli indubbi vantaggi che esso offre. Infatti, le tecniche online per il monitoraggio del biofilm rappresentano la scelta più idonea per ottenere un controllo microbiologico ottimale di un sistema. A questo proposito, sono disponibili una grande varietà di metodi online - e ciascuno di essi è basato su un diverso tipo di segnale che può essere ottenuto dal biofilm che viene analizzato. Solitamente basate su principi di trasferimento energetico, la maggior parte di queste tecniche misura una risposta passiva della superficie analizzata in seguito all'emissione di un segnale di input. Generalmente, tali segnali vengono trasmessi in continuo al campione, modificati dal deposito (qualora presente) e/o dal suo intorno, prima di essere rilevati. Per la maggior parte, questi metodi non sono specifici per il biofilm e non consentono, dunque, di distinguere tra lo strato batterico ed il deposito generico, o tra i batteri vivi e quelli morti. Questo punto ricopre un'importanza non trascurabile, poiché il monitoraggio del biofilm effettuato in maniera specifica offre vantaggi incalcolabili per quanto riguarda l'ottimizzazione dei trattamenti di sanificazione.
Applicazioni di laboratorio
Negli ultimi decenni sono state condotte molte ricerche nell'ambito del monitoraggio del biofilm e delle problematiche connesse, che, recentemente, hanno ricevuto crescente attenzione. Di conseguenza, sono state proposte un certo numero di tecniche analitiche, basate su fenomeni fisici correlabili alla crescita del biofilm. Tra questi ultimi si possono annoverare la spettroscopia ad impedenza elettrochimica (EIS), la frequenza di onde acustiche o vibrazionali, la diffusione, la trasduzione piezoelettrica, l'oscillazione termica e l'ottica di fluorescenza (v. figura sottostante). Di seguito, vengono riportati alcuni esempi riguardo l'applicazione di queste tecniche.
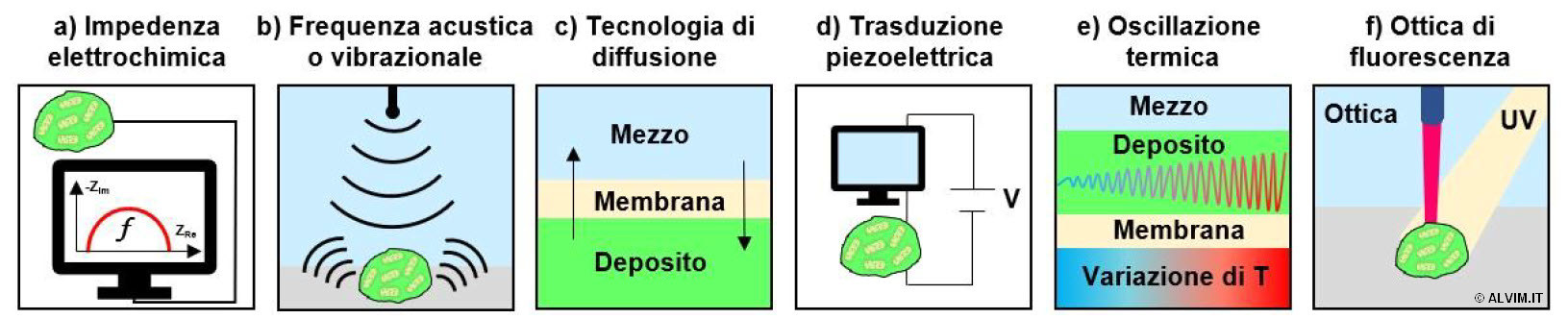
In numerose applicazioni, la formazione di biomassa su di una superficie sensibile viene monitorata per mezzo dell'inibizione del trasferimento di carica tra la sonda ed il liquido, effettuando una misura di EIS (v. figura sopra, punto a).
Alternativamente, è possibile effettuare la registrazione di variazioni acustiche o vibrazionali tra il liquido e corpi solidi, fornendo informazioni sull'estensione del biofilm e sul suo spessore (v. figura sopra, punto b).
Una differente tecnologia elettrochimica, che consente di misurare lo spessore del biofilm, si basa sulle proprietà di diffusione del deposito che si forma su di una sonda ricoperta da una membrana (v. figura sopra, punto c).
Sonde di quarzo a bassa frequenza di emissione possono anche essere impiegate come sensori monouso, allo scopo di monitorare la dinamica di crescita di biofilm sfruttando la relativa trasduzione piezoelettrica (v. figura sopra, punto d).
Un'ulteriore opzione consiste in rilevazioni termiche, che consentono di correlare le oscillazioni di temperatura con lo spessore del biofilm che cresce sulla superficie della sonda (v. figura sopra, punto e).
Infine, sensori di tipo ottico possono captare la fluorescenza di emissione del biofilm, in seguito ad un irraggiamento con luce ultravioletta. In questo caso, l'amminoacido naturale triptofano, ubiquitario nel materiale biologico, viene sfruttato come fluoroforo (v. figura sopra, punto f). È importante sottolineare che questa tecnica viene classificata come idonea per la distinzione del materiale biologico dal deposito inorganico. D'altra parte, essa non consente di effettuare alcuna distinzione tra batteri vivi e morti, né tra biofilm ed EPS.
Come anticipato, nessuno dei metodi sopracitati risulta specifico per il biofilm, non consentendo di distinguere lo strato batterico da altre tipologie di deposito, o i batteri vivi da quelli morti.
Applicazioni di campo
È possibile trovare sul mercato un certo numero di dispositivi volti al monitoraggio del biofilm o del biofouling, sia come prodotti venduti singolarmente che come elementi inclusi all'interno di un servizio di trattamento. Questi ultimi sono in genere basati su ispezione visiva, proprietà ottiche, capacità di scambio termico, onde ad ultrasuoni e determinazione di ATP. Di seguito vengono riportati alcuni esempi di questi dispositivi.
Un approccio base è costituito dall'impiego di coupon, pannelli o addirittura tubazioni trasparenti che vengono impiegati per visualizzare, ad occhio nudo o per mezzo di tecniche di imaging, la formazione di deposito sulla loro superficie e dunque, studiare il biofouling sulle superfici del sistema in cui sono inseriti. Nonostante osservare il biofouling sia certamente utile, questo approccio non consente di monitorare il biofilm nella sua fase iniziale di crescita e, quindi, di indicare le tempistiche più appropriate per la sanificazione.
I sistemi basati su sensori ottici forniscono una utile indicazione ma, in certi casi, essi determinano un incremento nella crescita di biofilm. Di conseguenza, il fenomeno biologico rilevato dal sistema ottico può risultare alterato, comportando quindi una sovrastima. Risulta di fondamentale importanza anche il fatto che le tecnologie ottiche in linea non consentano di distinguere tra biofilm e deposito generico.
Altri dispositivi commerciali consentono di valutare la crescita di biofilm tramite la misura della capacità di scambio termico del deposito che si forma sulla superficie della sonda. Come discusso in precedenza, anche in questo caso è il deposito generico ad essere monitorato, non il biofilm.
Sul mercato sono disponibili inoltre sensori ad ultrasuoni, utili per rilevare l'accumulo di deposito sulle superfici del sistema. Anche se questi dispositivi sono di fatto in gradi di distinguere tra depositi di tipo 'hard' e di tipo 'soft', essi non permettono di discernere tra biofilm ed altri depositi 'soft'. Inoltre, queste tecniche di monitoraggio subiscono diverse interferenze, incluse quelle causate da fluttuazioni minime di temperatura dell'acqua.
Infine, sono disponibili anche alcune applicazioni basate sulla determinazione dell'ATP. Queste ultime consentono di rilevare vantaggiosamente la formazione specifica di deposito biologico, a discapito di quello non biologico. Tuttavia non operano strettamente online, poiché il campionamento, seppure veloce ed automatico, resta comunque necessario. Di conseguenza, questi dispositivi risultano piuttosto complessi, e sono caratterizzati da OPEX e CAPEX elevati.
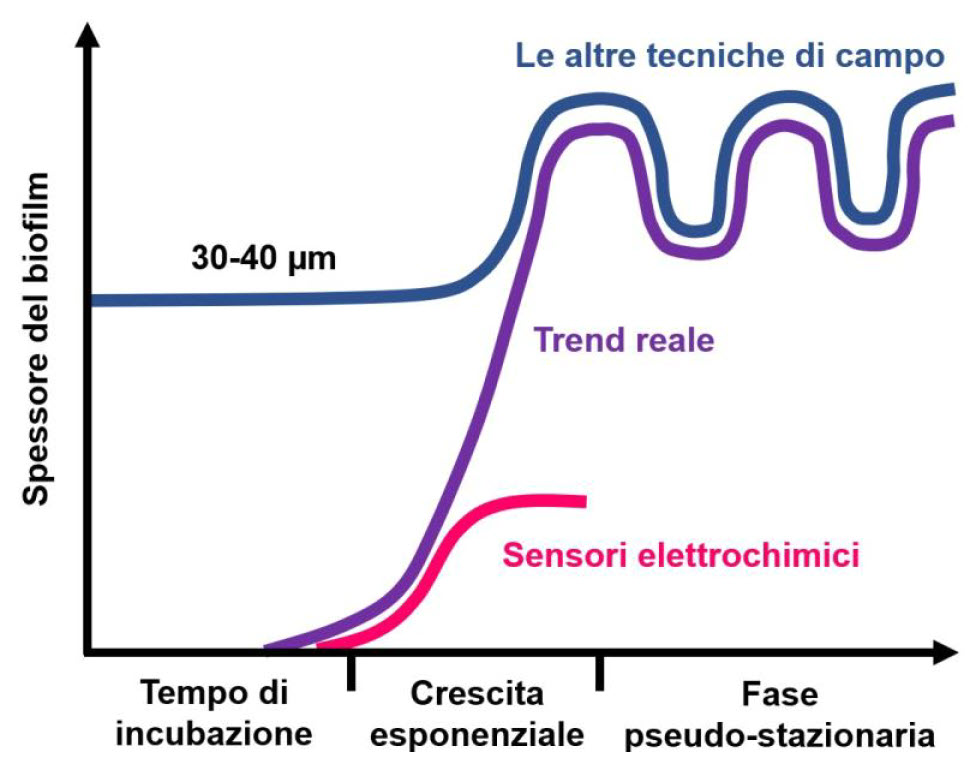
Allo stato attuale, le tecnologie scientificamente comprovate in grado di monitorare il biofilm in maniera specifica, ed al tempo spesso le più utilizzate in svariate applicazioni industriali, sono quelle basate sulla misurazione dell'attività elettrochimica dei batteri. Inoltre, se paragonati ad altre tecniche di campo, i dispositivi elettrochimici risultano molto più sensibili alla crescita di biofilm. Infatti, essi possono rilevare la formazione del primo strato di batteri (spessore inferiore ai 5 µm) mentre il limite di rilevabilità delle altre tecniche di campo è solitamente ben al di sopra dei 30 µm (v. figura a destra).
A questo proposito, il Sistema ALVIM è di gran lunga il sistema di monitoraggio biofilm più largamente conosciuto, validato ed impiegato a livello mondiale. Il Sistema ALVIM viene attualmente utilizzato dalle più grandi Aziende operanti nei settori Alimentare, Cartario, Petrolifero ed Energetico.
Prima di ALVIM, altri sensori elettrochimici, basati su una tecnica completamente diversa sono stati commercializzati da altre Aziende. Nonostante fossero basati anch'essi su un principio elettrochimico, nel loro caso il fenomeno di base non è mai studiato o validato completamente. L'occasionale mancanza di affidabilità e stabilità in concomitanza con piccole fluttuazioni di temperatura e flusso hanno limitato fortemente l'applicazione di tali tecnologie. Inoltre, in alcuni casi tali dispositivi generano sulla propria superficie un ambiente che promuove la crescita di biofilm. Di conseguenza l'indicazione fornita, in termini di crescita di biofilm, non può essere considerata come pienamente rappresentativa di ciò che accade nel sistema reale.
Al contrario, i Sensori ALVIM rilevano la reale crescita di biofilm, senza influenzarla. Il principio di funzionamento alla base del Sistema ALVIM, noto come 'depolarizzazione catodica' o 'ennoblement', è stato estensivamente studiato e validato, nell'arco di oltre 40 anni di ricerca pubblica e di terze parti. I Sensori ALVIM rilevano specificamente l'attività bioelettrochimica del biofilm batterico, rendendo possibile il monitoraggio del fenomeno sin dalla sua prima fase, con una sensibilità spesso superiore a quella della maggior parte delle tecniche di laboratorio. Dunque, viene fornito un segnale di tipo 'early warning', estremamente utile, poiché il primo strato di biofilm risulta il più semplice da rimuovere.
Riassumendo, il Sistema ALVIM offre tutte le più importanti caratteristiche necessarie a risolvere le problematiche connesse alla crescita di biofilm:
- monitoraggio online ed in real-time,
- rilevamento specifico del biofilm,
- elevata sensibilità (segnale tipo 'early warning')
|
Hai un problema simile con il biofilm?
|





