Contaminazione batterica nel settore alimentare [Scarica questo white paper come file PDF]
Nella produzione di alimenti e bevande risulta fondamentale prestare attenzione all'igiene di ambienti e impianti, poiché batteri e altri microrganismi possono proliferare molto rapidamente. All'interno di tubature e cisterne i microrganismi si possono trovare flottanti nel liquido (forma planctonica) o, più comunemente, insediati sulle superfici ("biofilm"). Il biofilm è una complessa comunità di microrganismi, principalmente batteri, adesi ad una superficie grazie a sostanze polimeriche extracellulari (EPS) secrete dai microrganismi stessi. Questa forma di vita sessile rappresenta un'eccellente tecnica di sopravvivenza, dato il numero di vantaggi strategici che offre, anche negli impianti di produzione alimentare. Questa è la ragione per la quale più del 90% dei batteri vive nel biofilm, anziché liberi nel liquido. Grazie alla sua struttura, il biofilm protegge i microrganismi da disinfettanti ed attacchi fisici. Infatti, la diffusione delle sostanze chimiche e l'accesso da parte degli agenti fisici risulta fortemente limitato dalla matrice di EPS.

Le comunità presenti nel biofilm sono solitamente formate da un'ampia varietà di specie batteriche in grado di scambiarsi materiale genetico, acquisendo in questo modo caratteristiche diverse, attraverso il meccanismo noto come "trasferimento genico orizzontale". I batteri che vivono all'interno del biofilm spesso "collaborano", ad esempio modificando la composizione chimica della matrice extracellulare al fine di acquisire una migliore resistenza agli agenti antimicrobici. In altri casi, il consumo di ossigeno da parte delle specie aerobiche crea un ambiente favorevole per i batteri anaerobi. Nell'industria alimentare, i prodotti freschi possono essere particolarmente vulnerabili alla formazione di biofilm costituito da specie patogene (Aeromonas hydrophila, Listeria monocytogenes, Salmonella enterica, Vibrio spp. e altri). Inoltre, i batteri che vivono nel biofilm possono provocare la corrosione delle tubature metalliche, portando a problemi economici e sanitari significativi. I biofilm sono in grado di aderire a un'ampia varietà di materiali, con composizione diversa. I materiali presenti all'interno delle industrie alimentari, come legno, vetro, acciaio inossidabile, polietilene, gomma, polipropilene, etc., funzionano bene come substrato artificiale per questi agenti patogeni. Controllare la formazione di biofilm può essere estremamente difficile, quando si tratta di selezionare la migliore strategia.
Per tale ragione sono necessarie tecniche accurate per il rilevamento precoce del biofilm, al fine di valutare la necessità e l'efficacia dei trattamenti sanificanti, volti ad evitare contaminazioni e garantire la sicurezza alimentare.
Problematiche associate ai batteri nella produzione di alimenti e bevande
Nella produzione alimentare i batteri flottanti nel liquido e, ancor più, quelli presenti nel biofilm sono responsabili di numerosi problemi, tra i quali la degradazione dei macchinari, l'aumento dei costi energetici, il deterioramento dei prodotti e le eventuali ricadute sulla salute dei consumatori. Con l'andare del tempo, i biofilm presenti nelle industrie alimentari, ad esempio quelle legate alla lavorazione di latticini, carne e pollame, pesce, birra, sono risultati essere più resistenti alle disinfezioni. Come precedentemente discusso, il biofilm è fino a 1000 volte più resistente ai trattamenti di sanificazione rispetto ai batteri planctonici, pertanto rimuoverlo dalle superfici degli impianti di produzione alimentare non è affatto semplice.
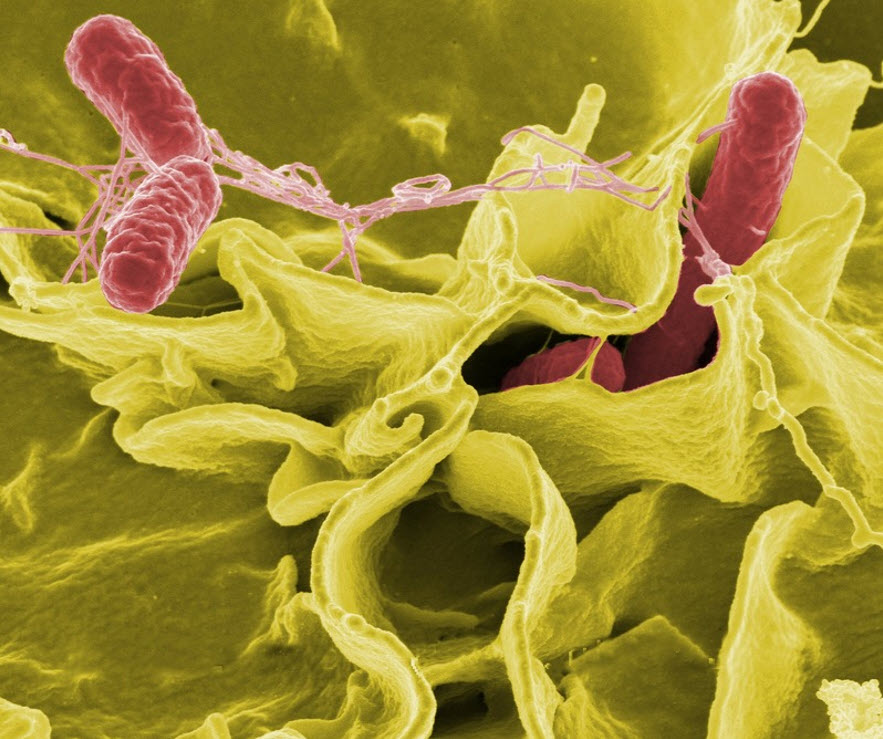
Le moderne linee di lavorazione alimentare sono un ambiente ideale per la formazione di questo strato batterico, principalmente a causa della complessità degli impianti di produzione, dei lunghi periodi di produzione, dei volumi prodotti e delle ampie superfici disponibili per la colonizzazione da parte dei microrganismi. Molti batteri potenzialmente presenti negli alimenti, compresi Listeria monocytogenes, Yersinia enterocolitica, Campylobacter jejuni, Salmonella spp., Staphylococcus spp., Bacillus cereus, e Escherichia coli possono quindi legarsi alle superfici di contatto in queste aree, aumentando il rischio per i consumatori finali. Come riportato dal National Institutes of Health, circa l'80% delle infezioni batteriche negli Stati Uniti è associato ai biofilm.
I componenti della matrice alimentare negli ambienti di lavorazione possono influenzare l'adesione batterica. Residui alimentari, come il latte e gli essudati di carne, ricchi di grassi, proteine e carboidrati, facilitano la crescita e la proliferazione dei microrganismi. Al fine di limitare il più possibile la contaminazione microbiologica degli impianti e delle attrezzature di produzione alimentare, risultano essenziali un design igienico e protocolli adeguati. A tal fine, le apparecchiature devono essere progettate in modo da evitare lacune, fessure e zone morte, dove i microrganismi possano rifugiarsi e crescere. Ciò è estremamente rilevante durante la produzione, quando i microrganismi possono crescere molto rapidamente in condizioni favorevoli. Il biofilm permette ai batteri di legarsi a svariati materiali, inclusi gomma, plastica, vetro, acciaio inossidabile e prodotti alimentari, nell'arco di pochi minuti. Più ruvida è la superficie, più facile è l'insediamento batterico. Successivamente può svilupparsi un biofilm maturo in pochi giorni - o, addirittura, in poche ore. Di conseguenza, materiali e superfici giocano un ruolo chiave nella prevenzione del biofilm.
Metodi di rilevamento
La presenza di diversi microrganismi, come Pseudomonas ssp., nei sistemi di lavorazione degli alimenti è comunemente dovuta a procedure igieniche inadeguate. Fortunatamente, nell'ultima decade, l'industria alimentare ha beneficiato di nuovi metodi rapidi per la valutazione dello stato igienico delle superfici di lavorazione degli alimenti. Sono disponibili diverse tecniche per valutare qualitativamente e quantitativamente sia i batteri che flottano liberamente che il biofilm - e ciascun metodo è utile per valutare un aspetto peculiare. Considerando la complessità e l'eterogeneità della struttura del biofilm, risulta necessario definire a priori l'obiettivo esatto dell'indagine. La quantità di EPS, il numero totale di cellule batteriche o il numero effettivo di batteri vivi devono essere considerati come obiettivi diversi, che richiedono approcci distinti. Si consideri che il volume del biofilm è rappresentano in larga parte dalla matrice extracellulare (65-95%), costituita principalmente di proteine, quindi polisaccaridi (1-2%), molecole di DNA (<1%), RNA (<1%) e ioni (legati e liberi). Il rilevamento dei batteri è stato trattato in maniera dettagliata in un precedente white paper.
Tecniche di laboratorio
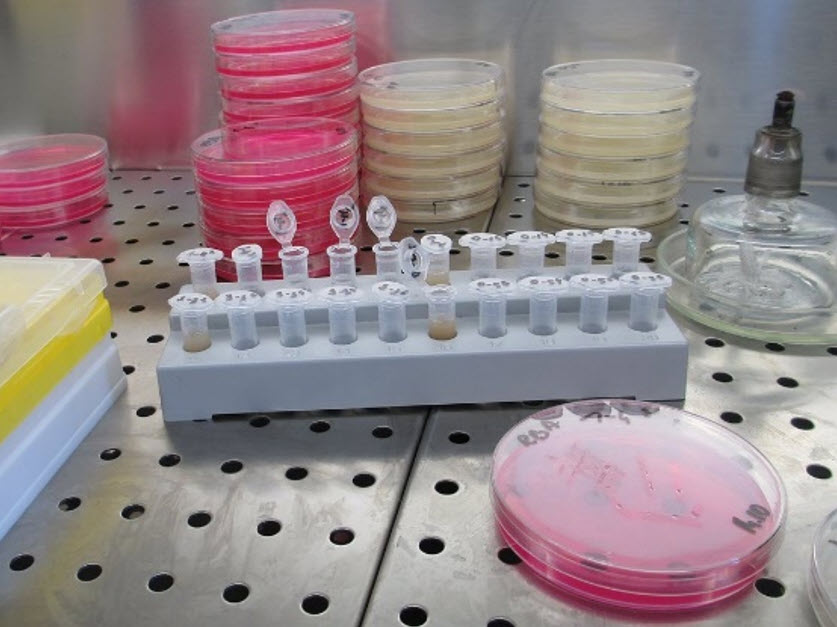
La stima del numero totale di batteri (total viable count, TVC) è la tecnica più utilizzata per quantificare l'abbondanza di batteri in un campione, di un liquido o prelevato da una superficie. Il motivo principale è che questa tecnica è semplice e non richiede attrezzature speciali. Vengono preparate diluizioni seriali del campione originale, le quali vengono poi piastrate su terreno agar. Il numero di unità formanti colonia (UFC) che crescono fornisce un'indicazione approssimativa dell'abbondanza batterica nel campione. L'analisi di batteri specifici può essere effettuata utilizzando terreni selezionati.
Questo metodo presenta notevoli inconvenienti e limitazioni. Innanzitutto il campione, sia di liquido che di biofilm, potrebbe non risultare rappresentativo della popolazione reale. In secondo luogo, può accadere che solo l'1% dei batteri presenti in un campione cresca su terreni di coltura di laboratorio. Inoltre, in alcuni casi può essere presente una vasta percentuale di cellule vitali ma non coltivabili (VBNC), che non possono essere rilevate mediante tecniche di coltura. Tutti questi punti possono portare ad un'ampia sottostima.
L'applicazione della citometria a flusso accoppiata ai fluorofori selezionati può rappresentare una valida alternativa, poiché con questa tecnica è possibile distinguere cellule totali, morte e VBNC.

La microscopia è un'altra tecnica ampiamente utilizzata in laboratorio, per studiare campioni prelevati dal processo. La microscopia a epifluorescenza, applicata a cellule marcate con un colorante fluorescente, fornisce un'ampia varietà di informazioni. Varie strutture cellulari possono fungere da target, in particolare la membrana cellulare, i nucleotidi e le proteine.
Possono essere utilizzate anche tecniche più avanzate, come la microscopia confocale a scansione laser (CLSM), la spettrometria di massa, la microscopia elettronica, la spettroscopia Raman, per ottenere informazioni complementari.
Il metodo Live/Dead, adatto per l'utilizzo in microscopia a epifluorescenza, CLSM, fluorometria e citometria a flusso, si basa sull'impiego di due diversi coloranti fluorescenti. Il primo colorante verde attraversa tutte le membrane batteriche e si lega al DNA sia dei batteri Gram-positivi che Gram-negativi. Il secondo, rosso, attraversa solo le membrane batteriche danneggiate. I batteri vivi emettono, dunque, fluorescenza in verde, mentre i batteri morti emettono fluorescenza in rosso. L'efficienza di entrambe le colorazioni è condizionata da alcuni fattori, quali l'affinità di legame del reagente alle cellule, lo stato fisiologico cellulare, la concentrazione del reagente, la temperatura ed il tempo di incubazione.
I sistemi di identificazione basati sugli acidi nucleici, comunemente noti come tecniche molecolari, possono migliorare significativamente la sensibilità, la specificità e la velocità dei test. Queste metodologie sono altamente affidabili e consentono una rapida individuazione di agenti patogeni negli alimenti. Tra queste, la più conosciuta è sicuramente la PCR, che permette di amplificare e rilevare una specifica sequenza di DNA, anche se presente in singola copia. Pertanto, la PCR può teoricamente rilevare anche un singolo microrganismo patogeno in un campione.
Sono stati sviluppati anche saggi PCR in tempo reale per il rilevamento rapido e la quantificazione di specifici batteri.
Sono disponibili ulteriori tecniche per quantificare il DNA, ciascuna con i propri vantaggi e svantaggi, oltre a diversi volumi di campione, attrezzature e requisiti.
La spettrofotometria UV, che utilizza l'assorbanza a 260 nm, è stata per decenni il metodo preferenziale per quantificare DNA e RNA. Risulta semplice e conveniente da usare, poiché non è richiesto alcun ulteriore trattamento del campione o reazione con altre sostanze. L'assorbanza dei campioni di DNA a 260 nm è comunemente misurata utilizzando uno spettrofotometro per microvolumi, ma è possibile utilizzare anche uno spettrofotometro a cuvetta o un lettore di micropiastre. Tuttavia, la spettrofotometria UV non risulta particolarmente specifica, poiché misura tutti gli acidi nucleici. È, inoltre, sensibile ai contaminanti. L'uso di coloranti fluorescenti consente la quantificazione del DNA con una sensibilità notevolmente più elevata (fino a 100x) rispetto alla misurazione dell'assorbanza del DNA stesso. Inoltre, coloranti specifici possono essere utilizzati per marcare tipi specifici di acido nucleico, aumentando così la specificità della quantificazione e riducendo l'impatto dei contaminanti. La misurazione della fluorescenza viene eseguita utilizzando un lettore di micropiastre o un fluorimetro a tubo singolo. Va notato che i metodi basati sulla fluorescenza sono più costosi della misurazione dell'assorbanza a 260 nm e, spesso, è richiesta la preparazione di una curva standard.
Un approccio più avanzato per studiare l'intera comunità microbica presente in una linea di produzione o in un prodotto finito si basa sulla metagenomica. Questa categoria comprende molte tecniche diverse che consentono di sequenziare il genoma di tutti i microrganismi presenti in uno stesso campione, identificandoli fino al livello di specie, nel migliore dei casi. Molti di questi organismi possono essere difficili da coltivare e identificare in laboratorio e la metagenomica aiuta a superare questo problema. La metagenomica non fornisce informazioni quantitative su ciascun gruppo di microrganismi, ma solo sulla loro abbondanza relativa. Un tempo queste tecniche erano utilizzate solo nella ricerca scientifica ma, grazie al calo del loro costo negli ultimi anni, sono diventate accessibili anche per applicazioni industriali.
Tecniche di campo
Utilizzando i principi della bioluminescenza dell'adenosina trifosfato (ATP), sono stati sviluppati metodi rapidi per applicazioni sul campo, basati sulla crescita microbica e sul metabolismo. Questo composto organico fornisce l'energia richiesta da molti processi nelle cellule viventi (inclusi i microrganismi), quindi è spesso indicato come "l'unità di valuta molecolare" del trasferimento di energia intracellulare. Il test è in grado di rilevare la quantità di ATP su una superficie, all'interno di un sistema di lavorazione degli alimenti, nonché nei campioni di prodotto. L'ATP reagisce con il complesso enzimatico luciferina-luciferasi, che trasforma l'energia chimica in luce, misurabile da un luminometro. Il risultato è espresso in unità luminose relative (Relative Light Units, RLU). Maggiore è la quantità di ATP in un campione, maggiore è l'emissione luminosa espressa in RLU.
Poiché questo metodo è veloce e richiede solo un piccolo e pratico dispositivo portatile, ha acquisito una significativa base di utenti nell'industria alimentare.
Si ritiene, comunemente, che il metodo della bioluminescenza dell'ATP sovrastimi la reale contaminazione microbiologica poiché, in alcuni casi, potrebbero essere rilevate anche cellule morte. Inoltre, non fornisce informazioni specifiche sui microrganismi e risulta avere una bassa affidabilità su superfici naturalmente contaminate. Per quest'ultimo motivo, viene comunemente applicato su superfici pulite.
Si deve considerare che i test chimici rapidi non sostituiscono direttamente i test microbiologici, ma forniscono informazioni complementari, che dovrebbero essere utilizzate come parte di una strategia integrata.
Un nuovo approccio è offerto dai Sensori di Biofilm ALVIM. Monitorando in linea e in tempo reale la crescita batterica sulle superfici, sin dalla sua prima fase, le sonde ALVIM consentono di prevenire i problemi legati al biofilm, inclusa la contaminazione microbiologica delle linee di produzione e dei prodotti finiti. Al tempo stesso, questa Tecnologia consente di verificare l'efficacia dei trattamenti di sanificazione, come discusso in specifici casi applicativi relativi alla produzione di alimenti, bibite, e imbottigliamento di acque minerali.
Metodi di sanificazione
Per prevenire i rischi legati ai batteri menzionati, nell'industria alimentare è necessario attuare rigorose procedure igieniche e di controllo. Con lo sviluppo di nuovi prodotti e nuove tecnologie e rilevanti scambi tra Paesi, il rischio di focolai di malattie di origine alimentare è sempre più elevato.
Il sistema HACCP (Hazard Analysis and Critical Control Points) e le buone pratiche di produzione sono stati sviluppati per garantire la sicurezza e la qualità degli alimenti. Come discusso in un precedente white paper, i biofilm batterici non sono menzionati direttamente nella maggior parte dei sistemi HACCP utilizzati negli impianti di lavorazione degli alimenti, e ciò rappresenta una grave carenza, poiché la maggior parte dei batteri che si possono trovare in un processo vive nel biofilm.

La strategia più diffusa per il controllo della proliferazione batterica nel settore alimentare è la sanificazione chimica, che combina detergenti e disinfettanti.
I detergenti alcalini e acidi eliminano i residui organici e inorganici dalle superfici. I disinfettanti eliminano patogeni e microrganismi responsabili del deterioramento dei prodotti, o ne riducono la presenza a livelli accettabili.
I disinfettanti più comunemente utilizzati nell'industria alimentare sono perossidi (acido peracetico e perossido di idrogeno), ipoclorito di sodio, composti di ammonio quaternario (QAC), composti anfoteri, aldeidi (formaldeide, glutaraldeide, paraformaldeide) e composti fenolici. Questa lista di prodotti non ha subito variazioni da molti anni. Più recentemente, le alchilammine e il biossido di cloro sono stati inseriti nei programmi di disinfezione.
L'acido peracetico (PAA) è ampiamente utilizzato dall'industria alimentare per controllare la proliferazione batterica. Il suo effetto antimicrobico è attribuito all'ossidazione dei gruppi tiolici nelle proteine, alla rottura delle membrane e al danneggiamento delle basi nel DNA. È stato dimostrato come il suo utilizzo aumenti la sensibilità delle spore batteriche al calore. L'efficacia e la sicurezza ambientale dell'acido peracetico ne fanno un agente disinfettante particolarmente idoneo all'uso industriale.
Nell'industria alimentare, l'ipoclorito di sodio (NaCIO) è uno dei disinfettanti più diffusi; reagisce con un'ampia gamma di molecole biologiche, come proteine, amminoacidi, lipidi, peptidi e DNA. La sua reazione produce sia acido ipocloroso (HOCl) che ione ipoclorito (ClO-), che sono forti agenti ossidanti che uccidono le cellule grazie alla loro capacità di attraversare la membrana cellulare. Tuttavia, l'ipoclorito di sodio presenta alcuni svantaggi (intervallo di pH e temperatura, sottoprodotti, ecc.) che spesso fanno preferire agli utenti altri prodotti disponibili sul mercato.
L'ammonio quaternario e i suoi composti, come benzalconio cloruro, cetrimide, didecildimetilammonio cloruro e cetilpiridinio cloruro, sono detergenti cationici. Riducono la tensione superficiale e formano micelle per portare alla dispersione in un liquido. Interagiscono non solo con la membrana cellulare dei batteri, ma anche con quella del lievito. La loro attività idrofobica li rende efficaci anche contro i virus. All'interno delle cellule microbiche, i QAC interagiscono con i bersagli intracellulari e si legano al DNA. Tuttavia, la loro efficacia è ancora messa in dubbio data la comparsa di una resistenza relativamente elevata in Listeria monocytogenes, Staphylococcus, e Pseudomonas isolati dai prodotti alimentari e dall'ambiente di lavorazione degli alimenti.
Negli ultimi anni, i trattamenti enzimatici sono stati sempre più utilizzati. Queste sostanze distruggono la matrice EPS del biofilm, aumentando così l'efficacia dei disinfettanti tradizionali. Tra i loro vantaggi vi sono la bassa tossicità e la biodegradabilità, ma il costo e i requisiti tecnici (temperatura, tempo di contatto) risultano in parte limitanti.
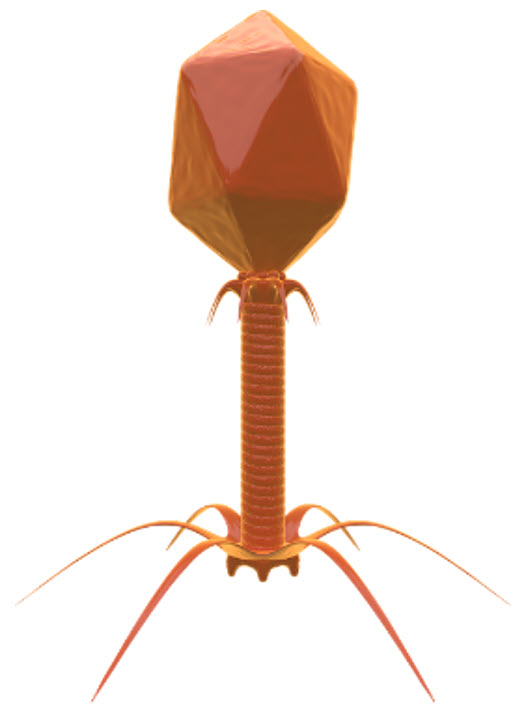
L'uso di batteriofagi per eliminare i batteri nelle applicazioni industriali è stato studiato per decenni. I batteriofagi sono virus che attaccano solo i batteri. Sono specifici di diversi sierotipi o ceppi microbici e sono parassiti obbligati, con un parassitismo genetico. Infatti, i batteriofagi sfruttano le cellule batteriche per replicarsi e, quando il processo è completo, distruggono la cellula ospite. Ciò significa che un'infezione da batteriofago può distruggere un'intera colonia batterica. Negli ultimi anni la FDA statunitense ha approvato i batteriofagi per combattere la presenza di L. monocytogenes negli alimenti.

L'applicazione della radiazione UV per la sterilizzazione è stata una pratica accettata sin dalla metà del XX secolo. È stato utilizzata per la prima volta in medicina, per il trattamento degli strumenti. I raggi UV possono essere suddivisi in diverse categorie; in particolare, quella a lunghezza d'onda corta (UVC) è considerata germicida. Infatti, a determinate lunghezze d'onda, i raggi UV risultano dannosi per batteri, virus e altri microrganismi. Alla lunghezza d'onda di 254 nm l'UV distrugge i legami molecolari del DNA, rendendo innocui i microrganismi, impedendone la crescita e la riproduzione. I microrganismi hanno una scarsa protezione dai raggi UV e non possono sopravvivere a un'esposizione prolungata.
L'efficacia della radiazione dipende da molti fattori: tempo di esposizione, variazioni della potenza della sorgente UV, che influisce sulla lunghezza d'onda elettromagnetica, presenza di particelle in grado di proteggere i microrganismi dai raggi UV e resistenza specifica dei microrganismi. In molti sistemi l'efficacia è aumentata dalla circolazione ripetuta dell'acqua sotto la sorgente UV, per accrescere la probabilità che la radiazione ultravioletta colpisca i microrganismi, irradiandoli più volte.
L'irradiazione UV viene generalmente utilizzata per sterilizzare acqua pulita, come l'acqua potabile e l'acqua distillata. Anche l'acqua utilizzata nell'industria alimentare può essere efficacemente sterilizzata dai raggi UV. Tuttavia, questa tecnica non può essere considerata efficace quanto i biocidi, soprattutto quando si tratta di biofilm. Infatti, l'irradiazione UV viene applicata ai batteri planctonici, e potrebbe quindi non risultare utile per eliminare il biofilm, nel caso in cui questo si formasse lontano dalla sorgente UV, non essendo in questo caso influenzato dal trattamento.
Conclusioni
I biofilm sono diventati una delle maggiori preoccupazioni nell'industria alimentare negli ultimi 30 anni. Questo argomento risulta estremamente importante a causa delle potenziali contaminazioni alimentari derivanti dal biofilm, poiché esso risulta fino a 1000 volte più resistente alla sanificazione rispetto alla sua controparte planctonica ed è responsabile di oltre il 20% dei casi di intossicazione alimentare. Molte specie batteriche hanno la capacità di formare biofilm, aumentando in questo modo la propria resistenza ad ambienti ostili, antibiotici e disinfettanti. Per questi motivi, è essenziale che l'industria alimentare metta in atto protocolli di pulizia e disinfezione volti a prevenire il biofilm, eliminandolo non appena inizi a formarsi. Infatti, una volta che questo strato microbico sia maturo può rivelarsi quasi impossibile da eliminare. Le nuove tecnologie attualmente disponibili per il rilevamento del biofilm nell'industria alimentare, in particolare quelle che consentono una rilevazione in linea e in tempo reale, ove possibile dovrebbero essere sempre applicate, per ottenere un allarme precoce ed applicare il trattamento più appropriato in maniera tempestiva.
|
Hai un problema simile con il biofilm?
|






